Segons una cita assignada a Hipòcrates (circa 460-370 a.C.), "tota malaltia comença a l'intestí". Encara que no es pugui saber del cert si la cita és real, és igualment cert per a moltes malalties humanes, tant desordres metabòlics (diabetis, inflamació crònica...) com neurològics i psiquiàtrics (autisme, demència, esquizofrènia...). Però, com pot ser que l'intestí sigui tan rellevant per a malalties tan diverses? En general, quan pensem en nosaltres mateixos, només mirem la part del cos visible i no ens adonem del prop de 2 quilos de microorganismes, principalment bacteris, que anomenem de forma genèrica microbiota (en un article previ us vaig explicar què és la microbiota i la seva relació amb la resposta a tractaments oncològics), que viuen envoltant el nostre cos, sobre la pell, ocupant totes les cavitats i obertures, incloent-hi el tub digestiu, des de la boca fins a l'anus. De fet, és cada cop més evident que la desregulació de la microbiota afecta directament el nostre benestar. Un altre dia parlaré de la relació entre la microbiota i les malalties metabòliques, però avui us volia parlar de la relació entre la microbiota del nostre intestí i el nostre cervell, el que s'ha anomenat l'eix microbiota-intestí-cervell.
Vivim en un món ple de microbis. Com us vaig explicar, quan naixem, els nostres intestins estan buits de microbioma i és la interacció amb el nostre ambient —el part vaginal, l'alletament amb llet materna, el contacte amb la pell de la mare, tot allò que toquem amb la mà i ens posem a la boca— la que farà que el nostre intestí es vagi omplint de diferents microorganismes. Aquests companys de viatge són molts i molt diferents, i aniran canviant al llarg dels anys. De fet, dins dels dos quilos de microorganismes del nostre cos, hi podem trobar genomes molt diversos, amb un gran nombre de gens diferents que codifiquen per funcions molt diverses. Dins del nostre intestí, els microorganismes hi troben productes que necessiten per créixer, i també alliberen metabòlits que absorbirem. Hi ha alguns investigadors que creuen que no podem analitzar només el genoma humà, sinó que hi hauríem d'incloure els genomes dels nostres microorganismes, en un hologenoma. Aquests investigadors consideren que cada humà seria un microecosistema en si mateix i, una mica filosòficament, ens consideren que no som éssers humans, sinó holobionts humans (nosaltres més tota la microbiota).
La cognició, la sociabilitat, la irritabilitat, la por, l'ansietat, fins i tot el progrés més ràpid d'algunes condicions psiquiàtriques o trastorns com ara l'autisme, es veuen afavorits o entorpits per la relació complexa que s'estableix entre determinats grups de bacteris i les nostres cèl·lules
Cada cop hi ha més evidències, particularment en animals model però també en estudis amb humans, de la comunicació entre la microbiota de l'intestí, les cèl·lules de l'epiteli intestinal i la subsegüent resposta neuronal. La cognició, la sociabilitat, la irritabilitat, la por, l'ansietat, fins i tot el progrés més ràpid d'algunes condicions psiquiàtriques, com ara la depressió o la demència, o trastorns com ara l'autisme, es veuen afavorits o entorpits per la relació complexa que s'estableix entre determinats grups de bacteris i les nostres cèl·lules, d'aquí el nom —oi que seria un bon títol per a una pel·lícula de ciència-ficció!— de psicobioma (el conjunt de bacteris i altres microorganismes que viuen i comparteixen espai dins del nostre cos però que tenen un efecte sobre el nostre sistema nerviós central i poden alterar com ens sentim, com pensem i com actuem). De manera molt gràfica, ja hi ha qui anomena l'intestí (evidentment, amb el microbioma!) el segon cervell.
Durant els últims anys els camps de la microbiologia i fisiologia han vist una revolució en aquest sentit. Per exemple, els ratolins que neixen i creixen en un medi totalment lliure de microorganismes (germen-free environment) presenten un desenvolupament diferent d'algunes regions del sistema nerviós, amb zones amb més dendrites, d'altres amb menys sinapsis, amb major mielinització però menor suport de glia. En ratolins, també s'ha comprovat que, depenent de les poblacions de diferents microorganismes intestinals, els animals es tornen més sociables o més irritables i agressius, i responen de manera molt diferent davant de situacions d'estrès i ansietat. Si canviem la femta d'un tipus d'animal a un altre, podem reproduir aquest tipus d'alteració davant l'estrès. D'altra banda, s'ha comprovat en humans que la femta de persones amb diferents tipus de trastorns psiquiàtrics presenta poblacions diferencials de bacteris, és a dir, amb certs tipus de bacteris que no són tan freqüents en persones no afectades, i viceversa. Vol dir això que els bacteris causen depressió? No, certament, però sí que podrien ser factors que ajudin a iniciar el desenvolupament (trigger) de determinats comportaments. Us adjunto una imatge molt reveladora, on es mostra la relació d'interdependència, en totes direccions, entre factors externs (dieta, medicaments) i factors genètics (major o menor susceptibilitat a patir certs trastorns i malalties) sobre la microbiota i, com a resultat, sobre el comportament, la cognició, l'ansietat o la resposta a l'estrès.
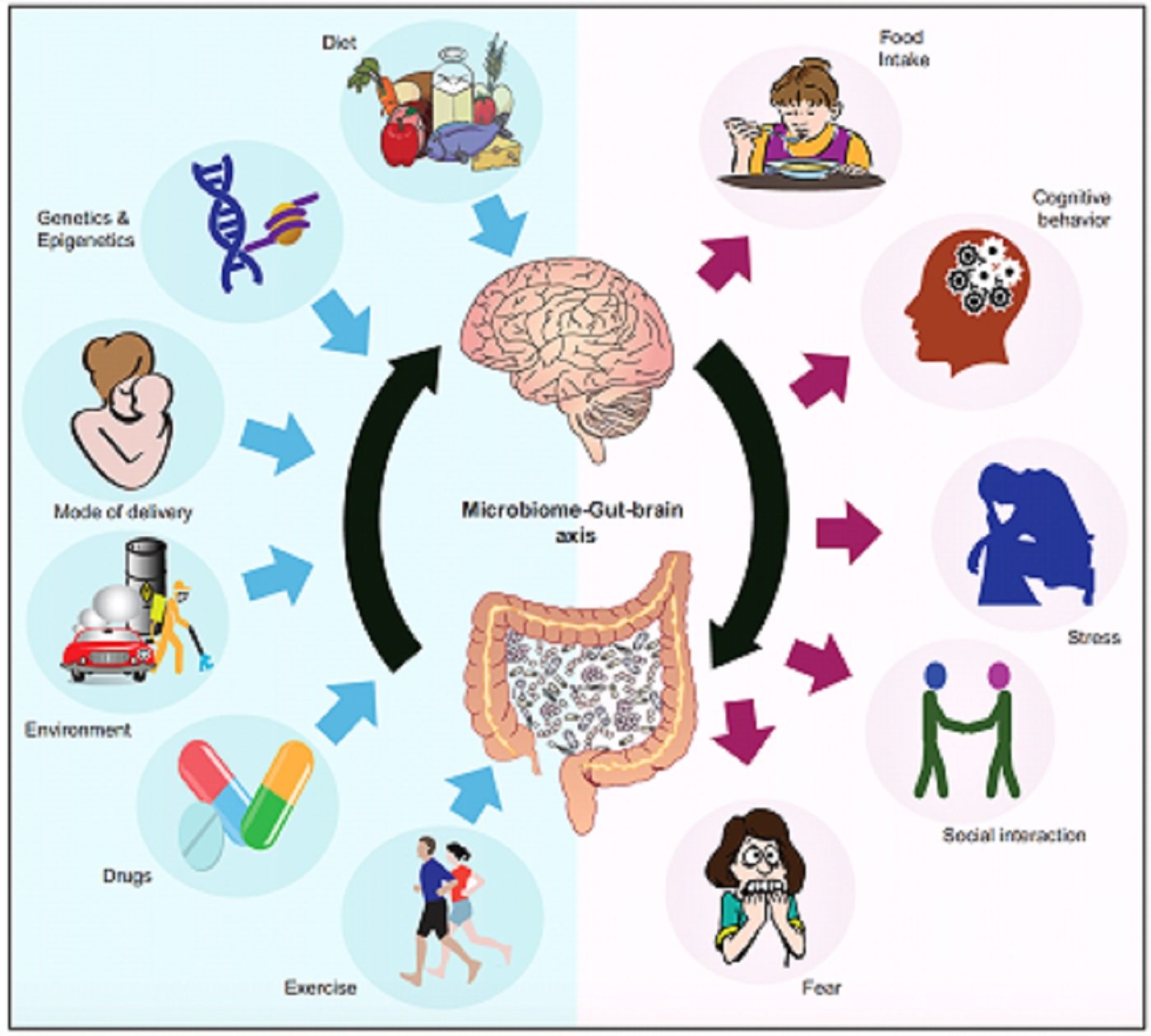 (Imatge extreta de Cryan et al., Physiol Rev 99: 1877–2013, 2019)
(Imatge extreta de Cryan et al., Physiol Rev 99: 1877–2013, 2019)
Podeu trobar una notícia ben recent sobre el psicobioma, en obert, a Science aquesta setmana, en la qual se'ns presenta els avenços d'una empresa spin-off dels Estats Units, que en els últims 5 anys s'ha dedicat a aïllar i caracteritzar els diferents bacteris de la femta humana (de moltes persones diferents) per tal d'aïllar nous compostos amb potencial efecte psiquiàtric. La seva idea no seria fabricar els compostos al laboratori com a medicaments, sinó proporcionar els bacteris directament a les persones, com a probiòtics (o millor dit, psicobiòtics), per tal que els bacteris colonitzin el nostre intestí i provoquin la resposta desitjada: sigui ajudant a metabolitzar components de la dieta o certs medicaments neuromoduladors específics, per tal que puguin tenir un efector protector o terapèutic; sigui provocant una resposta a nivell enteroendocrí o neuroendocrí (amb producció de serotonina, dopamina, àcid gamma-amino butíric, i altres neurotransmissors i hormones que afectarien el cervell i la resta del cos). Per exemple, l'alliberament de triptòfan per part de bacteris pot ser transformat metabòlicament per les cèl·lules del cos en serotonina (el neurotransmissor de la sensació de benestar, també anomenat el neurotransmissor de la felicitat), o en quinurenina (que genera nous metabòlits, tòxics per a les neurones). Diferències en el microbioma podrien determinar si guanya una via o l'altra.
Hi ha investigadors que diuen que la femta humana són les noves mines d'or de la medicina del futur, i que dins del camp de la biotecnologia hi ha una veritable febre de l'or, amb una competició aferrissada per identificar abans els microorganismes o la combinació de bacteris més adient per a obtenir determinats efectes psicobiòtics. Però s'ha d'anar amb compte, perquè la recerca científica, particularment, quan parlem de teràpies en humans, necessita evidències fermes i amb grups grans de persones. Encara ens queda molt a descobrir d'aquest món tan fascinant de la sinergia entre microorganismes i el nostre cervell que tenen com a interfície el nostre intestí.

